

2021年1月28日,北京大学基础医学院生理学与病理生理学系孔炜教授和孙金鹏教授合作,在《Cell Research》上发表了题为“Cartilage oligomeric matrix protein is an endogenousβ-arrestin-2-selective allosteric modulator of AT1 receptor counteracting vascular injury”的研究论文,首次发现内源性血管紧张素II受体AT1的偏好性抑制机制,具有重要的理论意义。

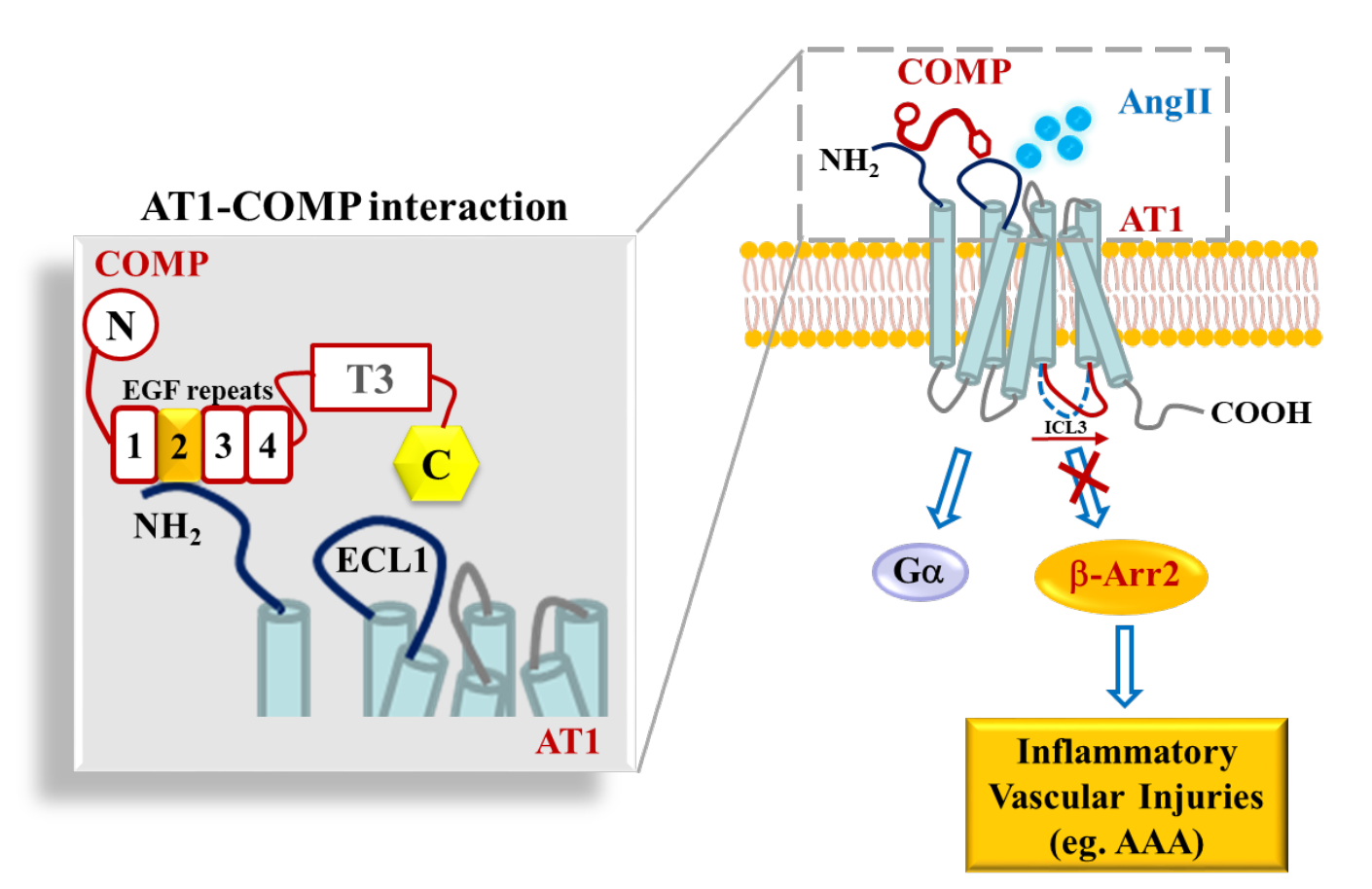
G蛋白偶联受体(GPCR)偏好性的激动或抑制可选择性地调控下游信号和相关功能,是近10年来GPCR药物开发的热点。AT1受体,属于GPCR,参与了多种重大心血管疾病的发生发展。目前已发现内源性AT1受体的偏好激动分子或因素,包括Ang1-7和机械牵张力,这些因素往往促进心血管疾病的发展,因此,体内可能也存在抑制AT1活力的内源性拮抗剂来维持血管稳态,但是否真正存在AT1受体的内源性拮抗剂尚不清楚。腹主动脉瘤是高度致死的心血管疾病,目前临床尚缺乏有效的药物治疗策略。该论文发现血管细胞外基质蛋白COMP(cartilage oligomeric matrix protein)是一种内源性AT1受体的偏好性变构调控分子,通过选择性抑制b-arrestin-2信号,进而发挥抑制腹主动脉瘤的保护作用。COMP也是我们所知的文献中第一个报道的GPCR内源性偏好性拮抗剂。人类编码800多个GPCR,是否其他GPCR也存在类似的内源性拮抗剂,来维持组织稳态,非常值得将来继续进行研究。
该研究首先通过病例对照试验,发现腹主动脉瘤患者血浆COMP水平显著下降,伴随腹主动脉瘤患病风险的显著增加。COMP缺陷显著加重血管紧张素II诱导的小鼠腹主动脉瘤,提示COMP具有抑制腹主动脉瘤发生与发展的保护作用。机制上,COMP缺陷并不影响血管紧张素II的产生和AT1受体的表达,但PLA、SPR、哺乳动物细胞双杂交和分子间BRET等实验,提示COMP可与AT1的N端胞外区直接结合。有趣的是,COMP并不影响AT1 下游G蛋白信号,但选择性抑制AT1-b-arrestin-2信号及其相关的AT1受体构像变化。同位素竞争结合实验表明,COMP只影响AT1/b-arrestin-2复合物的高亲和力配体结合,但不影响AT1受体本身的配体结合。这些研究结果证实COMP是AT1-b-arrestin-2信号的偏好性变构拮抗剂。COMP和AT1或COMP和b-arrestin-2的双敲小鼠,血管紧张素II诱导后的腹主动脉瘤发生率显著减少。COMP的EGF2结构域(53个氨基酸)介导了COMP与AT1受体胞外N端的结合,而在过表达EGF2模拟肽可显著抑制腹主动脉瘤的发生与发展,提示EGF2结构域具有潜在的临床转化应用意义。
北京大学基础医学院付毅副教授、北京大学第一医院黄娅茜副研究员和山东大学基础医学院杨照副教授为该论文的共同第一作者,北京大学基础医学院孔炜教授和孙金鹏教授为通讯作者。该工作还受到刘剑峰教授、王宪教授、徐清波教授、高培教授、王文恭教授和郭伟教授等的支持与合作。该项研究获得国家自然科学基金创新群体、杰出青年基金项目和国家重点研发计划的资助。
原文链接:https://doi.org/10.1038/s41422-020-00464-8
(基础医学院)