

2022年1月14日,北京大学基础医学院周菁课题组在Bioactive Materials在线发表了题为“Matrix stiffness exacerbates the proinflammatory responses of vascular smooth muscle cell through the DDR1-DNMT1 mechanotransduction axis”的研究论文。该研究报道了血管平滑肌细胞中的胶原受体——盘状结构域受体1(DDR1),可充当力学感受器,以不依赖于其配体的方式感知细胞外基质刚度升高,并介导胞内力学信号转导,抑制平滑肌细胞收缩功能并促进促炎因子合成,引起管壁微环境变化从而加重血管硬化。
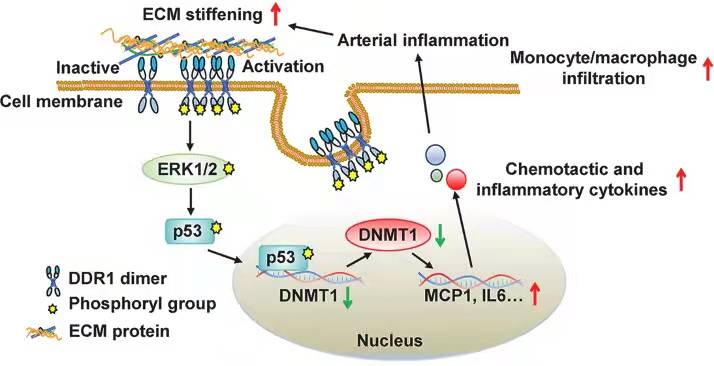
DDR1-DNMT1力学信号转导通路介导的血管平滑肌细胞功能调控示意图
血管平滑肌细胞具有高度可塑性,其表型可以响应多种微环境因素刺激而发生变化。其中,细胞外基质固有的机械信号(如基质刚度)可能与生物化学因素单独或协同作用,参与调控平滑肌细胞的表型与功能。在多种常见的慢性血管炎性疾病中,如动脉粥样硬化、高血压和术后狭窄,动脉壁刚度显著增加。病变血管中的平滑肌细胞呈现“合成”和“促炎”表型,从而分泌趋化因子和细胞因子,调控单核/巨噬细胞浸润,加重血管炎症。平滑肌细胞通过特定的机械力感受器感知微环境中的机械信号,并调控下游基因表达与活性,从而影响细胞功能。阐明平滑肌细胞如何感知与转导力学信号,可为改善血管壁力学微环境以及开发新型组织工程人工血管,从而预防与治疗血管疾病提供新的策略。
在该课题组的前期工作中(Biomaterials,2018),以聚丙烯酰胺水凝胶在体外模拟不同刚度细胞外基质微环境,曾发现高基质刚度引起DNA甲基转移酶1(DNMT1)的表达抑制,但其作用机理不明,尤其是高基质刚度如何被平滑肌细胞感知并引起DNMT1的下调并不清楚。在本工作中,课题组发现高基质刚度激活了平滑肌细胞中的酪氨酸激酶受体DDR1,表现为:以免疫印迹检测到其792酪氨酸位点高磷酸化、以超分辨显微技术观察到受体的簇集与内化、以原子力显微镜技术检测到受体与其配体的黏附事件发生率升高——提示受体-配体相互作用增强;且该工作明确了机械刺激引起的DDR1活化不依赖于其经典配体胶原与受体的结合。此外,该工作还揭示了由DDR1介导的细胞内力学信号转导通路,证明高基质刚度引起的DDR1激活通过ERK1/2-p53信号轴抑制下游靶基因DNMT1表达;利用平滑肌细胞特异性DNMT1缺陷小鼠和急、慢性血管硬化小鼠模型,发现DDR1-DNMT1信号轴在血管平滑肌细胞中调控细胞收缩功能和促炎因子的合成。
周菁课题组致力于对一系列模拟不同胞外物理微环境(如血流剪切和机械牵张、基质刚度与拓扑等)的在体和离体模型系统进行开发和应用,并利用其研究血管生理学和病理生理学尤其是动脉硬化的病理发生发展。北京大学基础医学院周菁研究员是本研究论文的通讯作者,北京大学基础医学院王谨博士、谢思安博士是本论文的共同第一作者。本研究得到了中科院力学研究所李宁副研究员与吕守芹研究员、清华大学赵虎成副教授、北京大学人民医院张韬副教授、北京大学天然药物及仿生药物国家重点实验室李文哲老师的帮助,得到了国家自然科学基金(面上、重大研究计划、创新研究群体项目)和北京大学医学部加强基础研究专项的经费支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S2452199X22000202
(北京大学基础医学院)