伊鸣和万有团队发现自发性疼痛的高级中枢机制
发布时间:2019-11-06
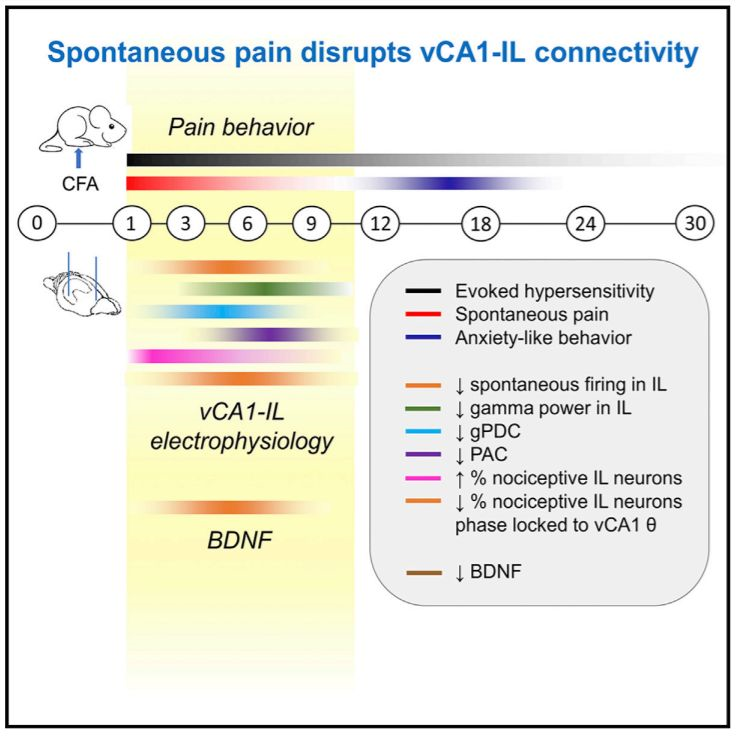
疼痛是最常见的临床症状之一。组织损伤早期的急性疼痛对个体的生存有重要的警示和保护意义,但持续存在的慢性疼痛包含自发性疼痛、温度和机械刺激导致的诱发痛敏、负性情绪和认知功能障碍等多种行为异常。流行病学调查显示,慢性痛发病率高达19%,严重影响患者工作能力和生活质量。自发性疼痛是慢性痛患者最重要的主诉,临床上主要通过“视觉模拟评分法(VAS)”进行评估。然而,由于我们难以和动物直接交流,使得动物模型上的疼痛机制研究多集中于诱发痛,而非临床意义更大的自发痛。这也是诸多在动物模型上效果显著的新型镇痛药屡屡在临床试验中失败的重要原因之一。脑功能成像研究初步提示,经典的“痛矩阵”脑区主要与诱发痛相关,而自发痛更多伴随边缘系统脑区功能变化,提示二者机制可能有所不同。总体而言,自发痛的高级中枢机制尚不清楚。2019年11月5日,来自北京大学神经科学研究所的伊鸣研究员和万有教授团队在Cell Reports杂志上在线发表题为Spontaneous pain disrupts ventral hippocampal CA1-infralimbic cortex connectivity and modulates pain progression in rats with peripheral inflammation的研究文章。该项研究通过长时程监测慢性炎症痛大鼠的行为和电生理变化,发现腹侧海马CA1−边缘下皮层通路(vCA1−IL)与自发性痛行为特异性相关。该研究首先观测了模型大鼠在整个炎症痛病程中的多个维度的行为特征。发现大鼠自发疼痛、诱发痛敏和负性情绪等行为在病程中具有独特的时间分布:自发痛主要出现于造模后早期(9天内),诱发痛更加持久(造模后21天内),而焦虑样行为出现于模型晚期(造模后14天左右)。然后,研究组通过自由活动大鼠在体电生理记录技术,长期检测vCA1−IL通路在整个炎症痛病程中的功能特征,发现两个脑区的电生理变化(包括功能连接度的降低、神经元放电率的下降、对伤害性刺激的反应性改变等)仅在大鼠自发疼痛持续的时间段内(9天内)最为显著。进一步研究发现,在这一时间段内,自发痛程度也与电生理改变程度正相关,而应用临床常用的镇痛药布洛芬在缓解大鼠自发痛的同时逆转了上述的电生理变化。这些证据提示,vCA1−IL通路的功能性异常与慢性炎症中的自发痛行为高度相关。进而,研究组利用光遗传学与化学遗传学技术挽救vCA1−IL通路的功能异常,发现炎症痛大鼠的自发疼痛行为显著减轻。并且,在自发痛行为明显的时间段内持续激活该通路,不但减轻自发痛,同时加速诱发痛敏的恢复并避免负性情绪的出现,从而缩短整个炎症疼痛病程。最后,研究组发现,脑源性神经营养因子(BDNF)含量降低与自发痛行为和vCA1−IL通路功能变化相关。通过遗传学方法特异性上调vCA1−IL通路BDNF表达可以有效逆转该通路电生理功能异常,减轻大鼠的自发疼痛,并促进慢性炎症痛的整体恢复。前期研究提示,海马与前额叶皮层活动与认知功能下降是临床发生慢性痛的重要危险因素。本项研究揭示了这一临床现象的生物学机制,发现与自发痛特异性相关的神经通路,并为慢性疼痛的基础研究与临床治疗开辟了新思路。伊鸣/万有团队近年来一直从事疼痛的高级中枢机制研究,于Journal of Neuroscience、Pain等期刊发表系列论文。本项研究代表了该方向的最新进展。北京大学神经科学研究所的博士研究生马龙雨和中国科学院心理研究所的博士后岳路鹏为本文的共同第一作者,伊鸣研究员和万有教授为共同通讯作者。