

2022年10月27日,北京大学药学院化学生物学系和天然药物及仿生药物国家重点实验室王晶团队联合北京大学生命科学学院伊成器团队在国际顶级学术期刊Nature Biotechnology杂志上发表了题为“Absolute quantification of single-base m6A methylation in the mammalian transcriptome using GLORI”的研究成果。

m6A是高等真核生物mRNA内部含量最丰富的修饰,大约0.2-0.6 %的腺苷中存在m6A修饰。m6A依赖修饰酶、去修饰酶和结合蛋白发挥调控功能。目前已发现m6A具有调控mRNA剪接、出核、稳定性和蛋白翻译等功能,可以参与发育、配子发生、细胞重编程、生物节律、疾病等多种生理和病理过程的功能调控。为了更好地研究m6A生物功能和临床病理研究,开发m6A高通量测序技术一直是m6A领域的热点。
尽管当下已经开发了多种m6A检测和测序方法,但是现有的技术仍然存在几个重要的局限性:(1) 基于m6A抗体的检测方法无法获得其高分辨率的位点信息。(2)基于限制性内切酶的检测技术只能检测含有ACA 基序的m6A。(3)基于三代测序和机器学习的方法。尽管这种方法能够提供m6A的单碱基信息且能够进行定量,但是三代测序存在价格昂贵、检测准确性低等问题,且不能够实现对m6A的绝对定量。迄今为止,对m6A全转录组的无偏好检测和绝对定量仍未得到解决。
王晶团队开发的m6A检测技术“GLORI” (Glyoxal and nitrite-mediated deamination of unmethylated adenosine)突破了以上技术的局限性,首次实现了真正意义的高效率、高灵敏度、高特异性、无偏好单碱基m6A位点检测,并对m6A位点的修饰水平进行绝对定量。GLORI的技术核心是不依赖于抗体,通过化学反应组合筛选发现乙二醛和亚硝酸盐的催化体系,对未甲基化的腺苷进行高效地脱氨从而形成肌苷(A-to-I, > 98%),肌苷在测序过程中被读成鸟苷(G),形成A-to-G的转化;而m6A测序后仍被读成A,从而实现对m6A的单碱基识别。GLORI通过检测测序的读段序列中A所占的比例,实现了对单碱基m6A的绝对定量。因此,GLORI技术在概念上类似于利用亚硫酸氢盐定量分析基因组5mC的方法。
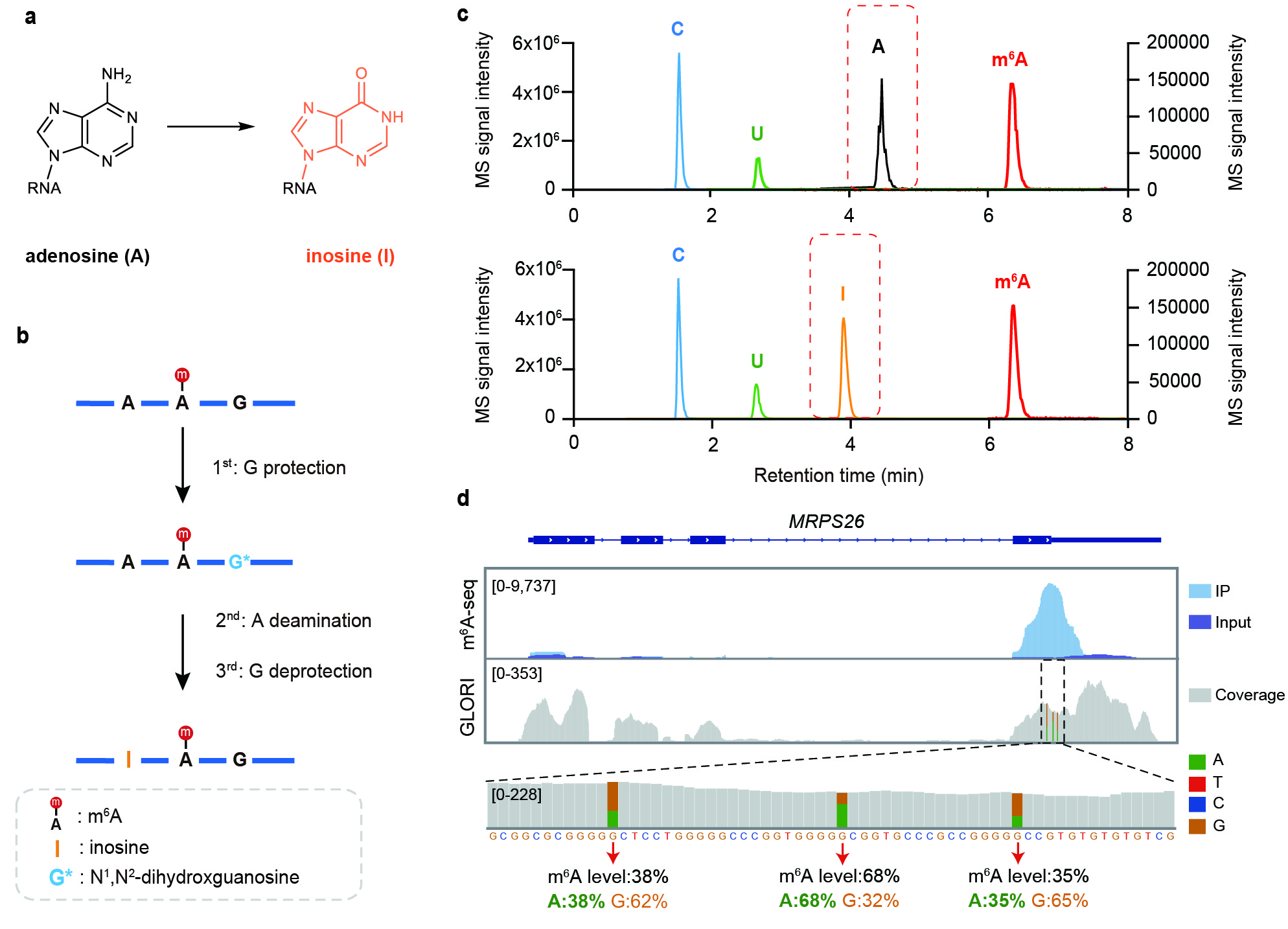
图1:GLORI 的检测原理。a, GLORI实现A-to-I的转化。b, GLORI的化学反应过程。c, GLORI中乙二醛和亚硝酸盐介导脱氨作用前后(上)和(下)的LC-MS/MS分析。d, GLORI技术在基因MRPS26上定量检测m6A位点的例子。
随后,王晶团队与北京大学生命科学学院伊成器团队合作在HEK293T转录组中,鉴定出了176,642个m6A位点,并且发现随着测序深度的增加,可检测的m6A位点仍未饱和,该结果扩展了人们对mRNA上m6A存在数量的认识。此外,GLORI技术能够实现对m6A的准确定量:即使修饰水平较低的m6A(5%),GLORI也能够实现准确检测。对含有不同m6A修饰水平的mRNA进行进一步功能分析后发现,mRNA上整体m6A的修饰水平和RNA的转录水平及翻译效率都呈现负相关。至此,我们利用GLORI技术首次实现了全转录组的m6A定量图谱,也完成了对基因表达和翻译调控的定量评估。
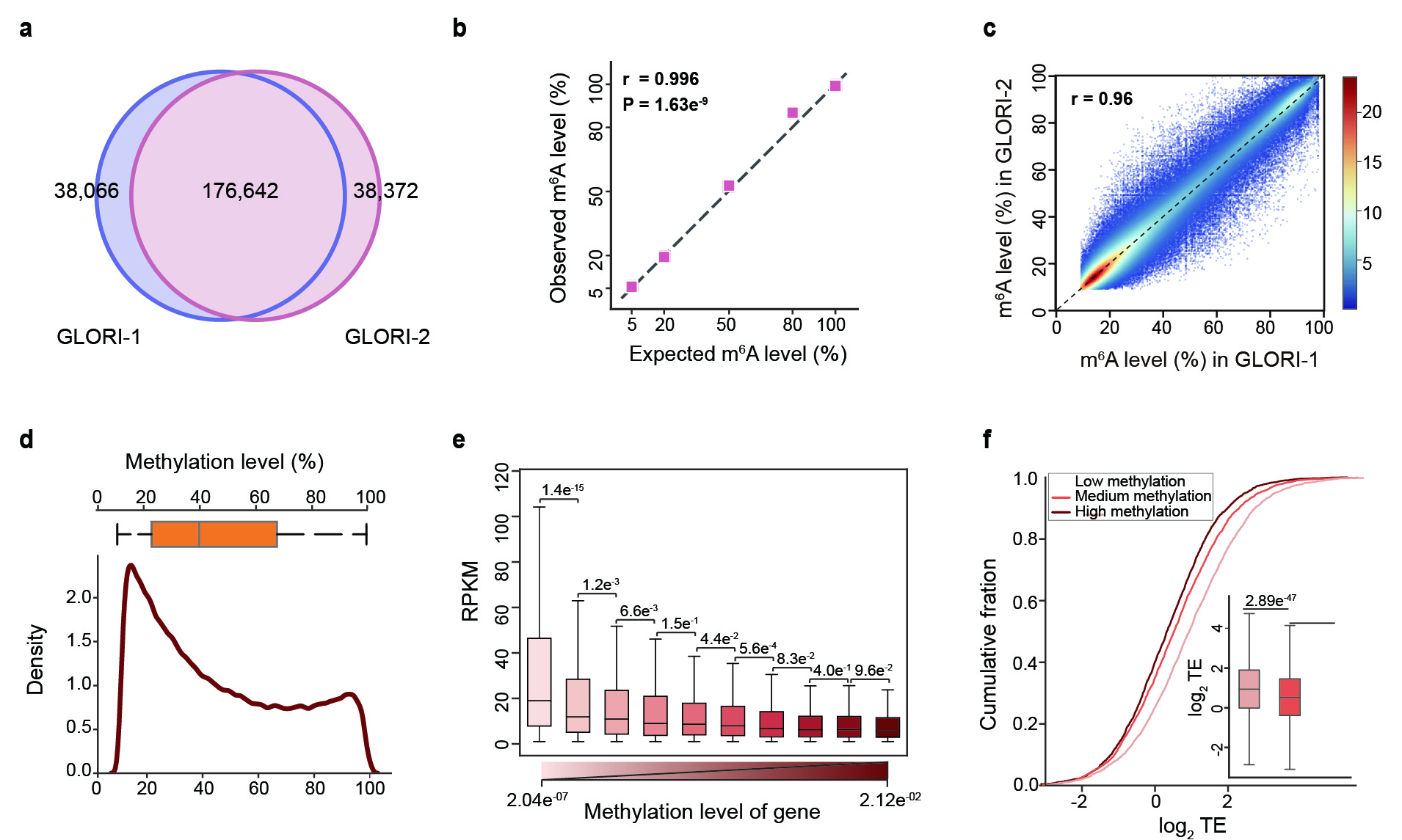
图2:GLORI转录组内定量检测m6A。a, GLORI在HEK293中检测的位点。b, GLORI能够准确检测spike-in中m6A位点的修饰水平。c, GLORI检测的m6A位点的修饰水平在技术重复之间的相关性。d,HEK293中m6A位点修饰水平的整体分布。e, 含有不同m6A修饰水平的mRNA的转录水平。f, 含有不同m6A修饰水平的mRNA的翻译效率比较。
此外,王晶团队还发现在一些基因的特定区域中出现了一类聚集分布的m6A位点(m6A簇)。相比于不具有这类m6A簇的基因,这类m6A簇的基因显著降低基因的转录水平和翻译效率,从而发挥负调控基因的表达的作用。
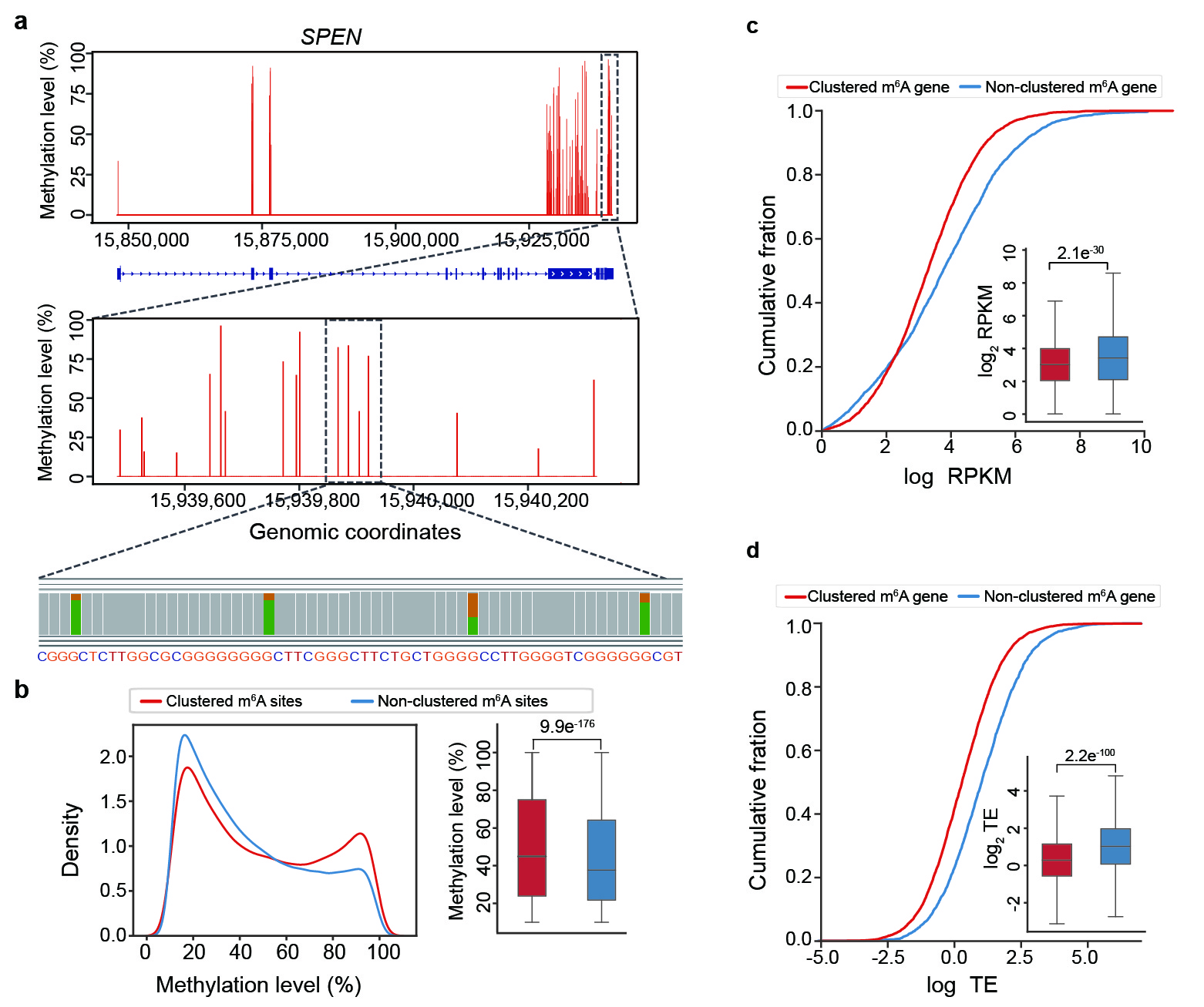
图3:m6A簇的发现与功能。a, SPEN基因的特定区域有聚集分布的m6A簇。b, 参与形成m6A簇的m6A位点具有显著高的修饰水平。c, 具有m6A簇的mRNA具有显著低的转录水平。d,具有m6A簇的mRNA具有显著低的翻译效率。
最后,王晶团队将GLORI技术应用于HeLa及MEF两种细胞系中存在热休克及缺氧的两种压力条件下,进一步观察m6A的动态调控并提供了转录组上m6A对压力条件应激的定量图谱。结果表明在两种压力体系下约有4.8-11% m6A位点具有动态变化,并且上调和下调的m6A位点表现出不同的富集模式:在缺氧时,上调和下调的m6A位点主要富集在5′UTR和终止密码子附近,而热休克体系中这种富集则呈现相反的结果。不同于野生型细胞中m6A对基因表达的负调控作用:在热休克条件下,m6A整体修饰水平升高的mRNA的翻译效率显著上调,且这种上调的调控作用在具有m6A簇的mRNA中更为显著。该结果提示了m6A在不同环境下对基因表达中具有特异性的调控,也为后续研究m6A动态调控的生物学功能提供了有力的技术工具。
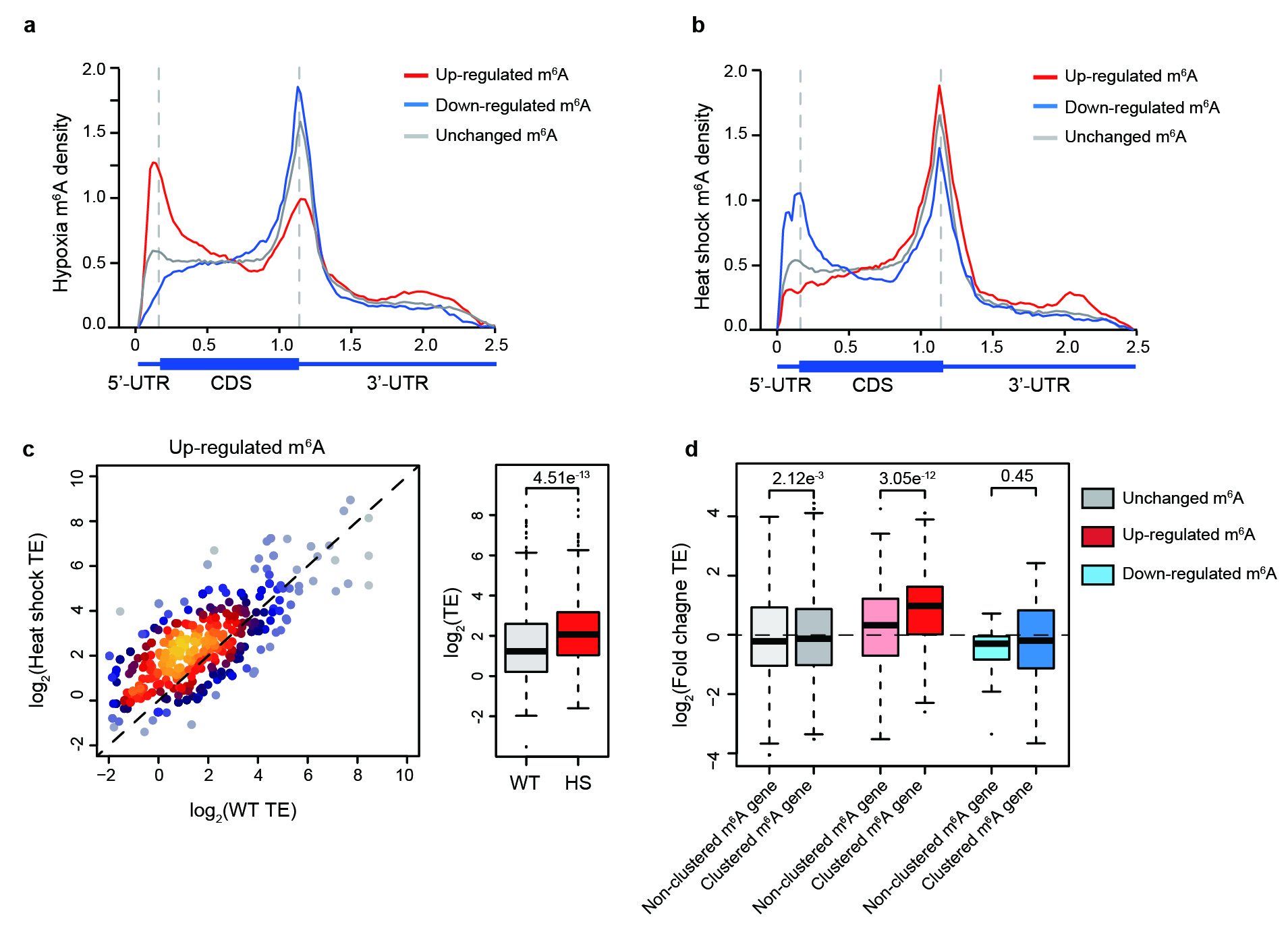
图4:GLORI检测动态变化的m6A。a, 缺氧诱导m6A位点的mRNA分布图谱。b, 热休克诱导m6A位点的mRNA分布图谱。c, 热休克前后MEF细胞中上调m6A相关基因翻译效率的箱线图和点图。d, 热休克后具有或不具有m6A簇的基因的翻译效率的箱线图。
综上,该研究展示了GLORI技术高灵敏度、高特异性的无偏好单碱基绝对定量检测m6A的特性,攻克了当下m6A定量测序技术的瓶颈。基于其在检测m6A方面的优异表现,GLORI将有助于推动和解决m6A在细胞分化、胚胎发育和临床检测等多种领域中的功能研究和核心生物学问题, 有望成为定量m6A测序技术的“金标准” 。

博士后衣云鹏 直博生申卫国
北京大学药学院王晶研究员和北京大学生命科学学院伊成器教授为本研究论文的通讯作者。北京大学药学院2018年博士后衣云鹏(已出站)和2018级直博生申卫国,以及北京大学生命科学学院的博士后刘聪,博士生孙含笑,李楷(已毕业)为论文的共同第一作者。该工作得到科技部重点研发计划和国家自然科学基金委等项目资助。
原文链接:https://www.nature.com/articles/s41587-022-01487-9
(药学院天然药物及仿生药物国家重点实验室)