

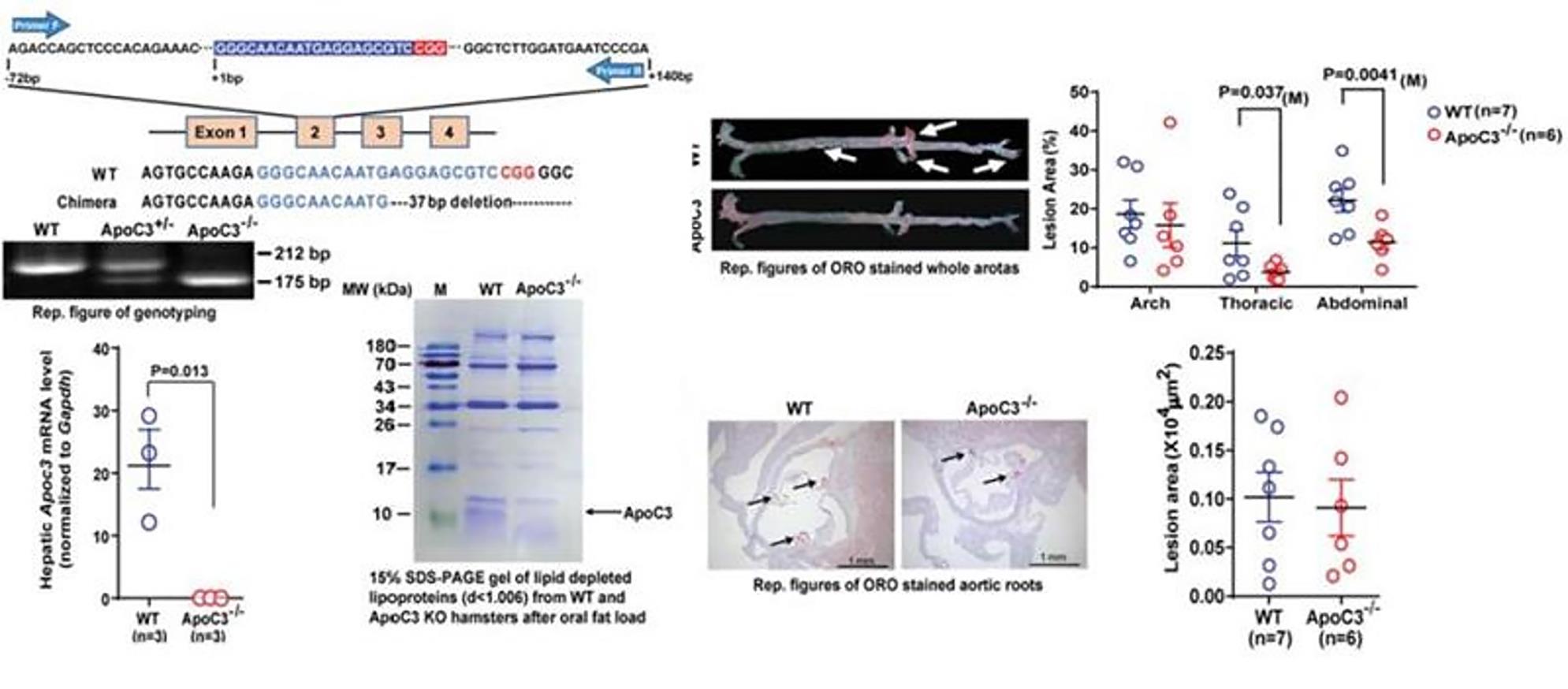
近日,北京大学心血管研究所冼勋德、刘国庆教授团队在Circulation Research在线发表了文章Inactivation of ApoC3 by CRISPR/Cas9 protects against atherosclerosis in hamster。他们应用CRISPR/Cas9技术,成功建立了拟人化的载脂蛋白C3(ApoC3)基因敲除仓鼠模型。这种动物的血浆甘油三酯(TG)减低,在喂饲高脂饲料后高密度脂蛋白(HDL)则增高,同时动脉粥样硬化病变较野生型仓鼠明显减轻,表明ApoC3基因敲除仓鼠是研究ApoC3作为人类心血管疾病靶点的理想模型。
仓鼠是一种在脂代谢方面类似于人的小型啮齿类动物,具有繁殖快,饲养简易和费用低廉的特点,只是因为体外胚胎操作困难,迟迟没有基因工程模型问世。北京大学基础医学院冼勋德、刘国庆教授团队在率先建立转基因仓鼠模型的基础上,近两年来又成功构建了具有自主知识产权的LDL受体缺陷、卵磷脂-胆固醇酰基转移酶(LCAT)缺陷以及ApoC2缺陷等仓鼠模型(相关文章分别发表于EBiomedicine 2018,Metabolism 2019、 2020,ATVB 2020等主流杂志),形成了拟人化的坏胆固醇增高、好胆固醇减少和甘油三酯增高的人类脂代谢紊乱仓鼠模型系列,为心血管疾病的转化医学研究搭建了理想平台。为体现这些仓鼠模型的中国原创特色,该团队以中国大城市命名这些仓鼠模型,包括中华仓鼠(GFP转基因仓鼠),北京仓鼠(LDL受体敲除),上海仓鼠(LCAT敲除),长沙仓鼠(ApoC2敲除),石家庄仓鼠(ABCA1敲除),天津仓鼠(IDOL敲除),重庆仓鼠(ApoA5敲除),广州仓鼠(IL10敲除)等。
本次冼勋德、刘国庆团队研究的ApoC3敲除仓鼠模型命名为深圳仓鼠。利用这种仓鼠模型,该团队证明,敲除ApoC3不仅降低血浆甘油三酯,同时可以减轻动脉粥样硬化病变,为进一步探索ApoC3对心血管疾病的作用机制奠定了基础。
北京大学基础医学院心血管研究所2017级硕士研究生郭梦梦和河北医科大学2019级硕士研究生徐一童为论文共同第一作者。
原文链接:https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.120.317686
冼勋德,2019年受聘于北京大学心血管研究所任助理教授,分子心血管教育部重点实验室PI。2008年北医生理系获博士学位后赴美在1985年诺贝尔生理与医学奖获得者Michael Brown/Joseph Goldstein的美国德州西南医学中心从事博士后,讲师和助理教授工作,长期致力于脂蛋白受体对多种代谢性疾病影响的研究,包括动脉粥样硬化,糖尿病,肥胖以及神经退行性疾病。
刘国庆,北京大学心血管研究所退休教师,曾长期从事脂蛋白代谢和动脉粥样硬化研究,在国际上率先建立了多种脂代谢紊乱的基因工程仓鼠模型。

(北京大学基础医学院)