

作为生物体所必需的微量元素,铁离子参与了细胞的增殖、代谢和分化。尤其是近年来得到更多关注的铁死亡(Ferroptosis),更增强了研究人员对肿瘤细胞中铁离子代谢和转运机制的关注。和传统的凋亡(apoptosis)不同,依赖铁离子的细胞程序性死亡是一种全新的细胞死亡方式。细胞内氧自由基(ROS)调节失衡导致的脂质过氧化,是引发铁死亡的关键。至今,铁死亡已被发现与神经系统疾病、急性肾损伤等多种疾病相关,铁死亡影响肿瘤远端转移的研究,更将铁死亡的探索推到了风口浪尖。尽管目前已经发现多种氧化还原酶参与铁死亡的生物学过程,但是其关键调节因子---铁离子的代谢机制,目前尚未完全明晰。

2021年1月,北京大学基础医学院游富平研究员团队、吕丹研究员团队以及尹玉新教授团队在EMBO Reports在线发表题为”The deubiquitinase OTUD1 enhances iron transportation and potentiates host antitumor immunity”的成果,首次报道OTUD1作为铁离子转运的正调控因子,促进细胞内铁离子吸收、增强铁死亡敏感性,最终增强宿主抗肿瘤免疫应答(图1)。
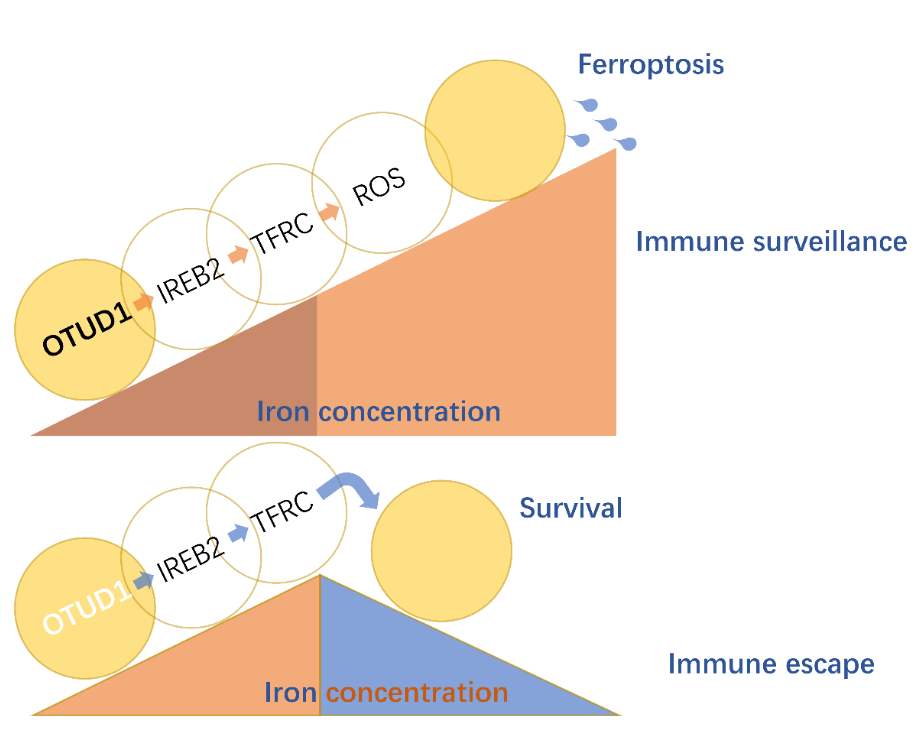
图1. OTUD1通过激活IREB2-TFRC信号通路,从而促进细胞内的铁离子浓度,提升细胞对铁死亡的敏感性,最终促进危险相关分子模式的释放和宿主免疫应答
这一研究,首次鉴定到抑癌基因OTUD1在肠癌组织中特异性下调表达。结合临床信息分析发现,OTUD1表达越低的肿瘤患者,其预后较差。有意思的是,尽管体外实验和裸鼠荷瘤实验显示,恢复细胞中OTUD1表达并不影响肿瘤的生长,但是在野生型小鼠体内,过表达OTUD1却可以显著抑制肿瘤的大小,明显延长荷瘤小鼠的生存时间,从而提示OTUD1可能参与宿主抗肿瘤免疫应答过程。研究显示,OTUD1的表达提高了肿瘤细胞中铁离子的浓度,促进肿瘤细胞中ROS的产生以及肿瘤微环境中CD8+ T细胞的浸润。在机制方面,OTUD1可以直接结合并促进铁反应元件结合蛋白2(IREB2)的去泛素化,从而抑制IREB2蛋白的降解,激活其下游基因TFRC的表达。作为人体内重要的转铁蛋白,TFRC的表达上调直接导致细胞内铁离子聚集、ROS水平增高以及细胞对铁死亡的敏感性的提升。和凋亡不同,本研究发现肿瘤细胞铁死亡可以释放多种危险相关分子模式(DAMPs),从而招募更多免疫细胞的浸润,最终提高宿主抗肿瘤免疫应答的能力(图2)。
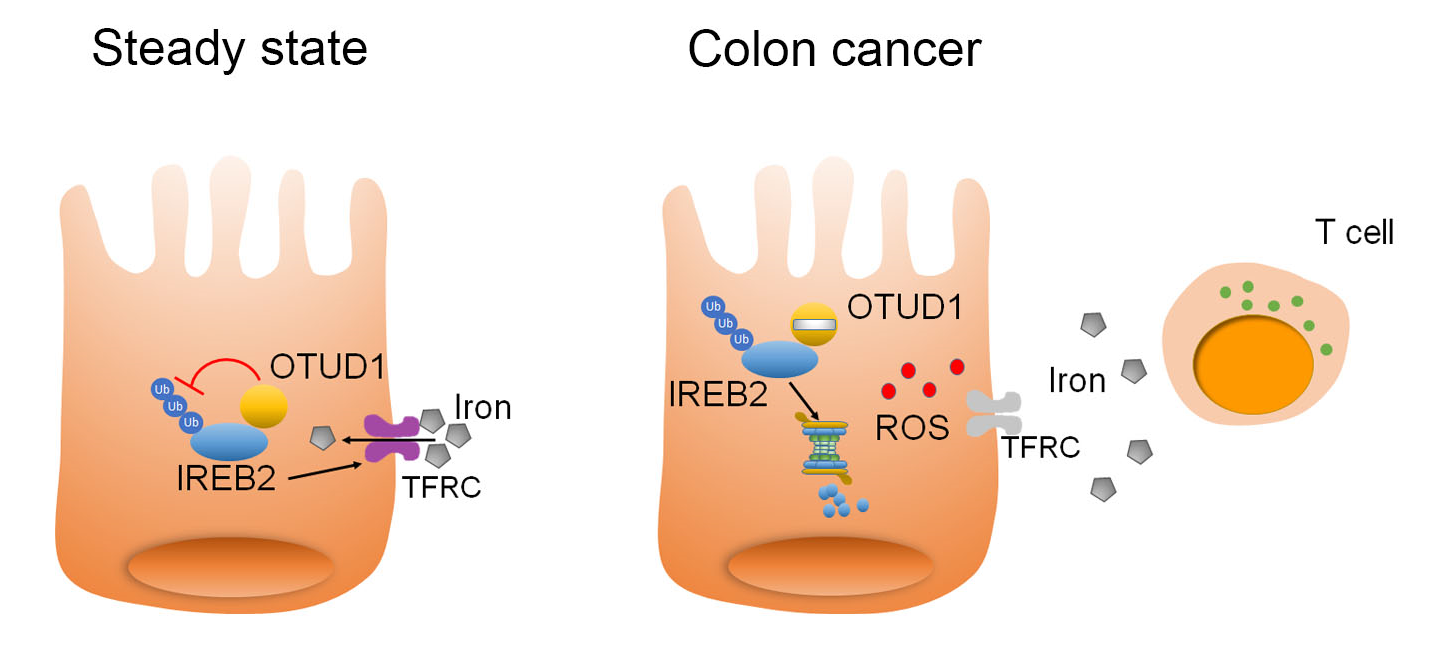
图2. 肿瘤细胞通过限制OTUD1的表达,增强IREB2泛素化水平,从而加快肿瘤中IREB2蛋白降解、抑制了细胞内铁离子的转运,最终阻止铁死亡的产生和T细胞的攻击
综上所述,本研究鉴定到具有调控铁离子代谢功能的OTUD1作为肿瘤中重要的免疫激活因子,通过诱导铁死亡,促进肿瘤细胞的免疫清除作用。本项研究为全面阐明肠癌细胞免疫逃逸过程提供了一种全新的机制,同时也为肠癌的免疫治疗提供了潜在的新型药物靶点。
北京大学基础医学院博士生宋佳和刘通通为该论文的共同第一作者,北京大学基础医学院游富平研究员、吕丹研究员和尹玉新教授为通讯作者。该项研究获得国家重点研发计划、国家自然科学基金、北京大学医学部青年学者培养基金等项目的资助。
(北京大学基础医学院)