

2022年2月8日,北京大学基础医学院尹玉新教授团队在Molecular Cancer在线发表了题为“circPTEN1, a circular RNA generated from PTEN, suppresses cancer progression through inhibition of TGF-β/Smad signaling”的研究论文,鉴定了一种由抑癌基因PTEN编码的环状RNA,命名为circPTEN1。circPTEN1可以干扰TGF-β/Smad通路介导的转移关键基因的转录激活,进而抑制结直肠癌的侵袭和转移。circPTEN1的发现为肿瘤转移研究提供了新的思路和潜在治疗靶点。
PTEN(Phosphatase and tensin homolog deleted on chromosome 10)是人类肿瘤中突变率最高的基因之一,肿瘤数据库统计显示,PTEN基因在不同组织来源肿瘤中共发现超过2700多种突变。作为最重要的抑癌基因之一,PTEN基因转录水平以及蛋白合成方面的微小变化即可对肿瘤生成产生重要影响。PTEN基因敲除小鼠多脏器发生肿瘤,表明PTEN在抑制肿瘤发生过程中发挥重要作用。
具有脂质和蛋白质双重磷酸酶活性的PTEN蛋白可通过多种机制抑制肿瘤,其经典抑癌途径为将胞浆PIP3去磷酸化为PIP2,抑制PI3K/AKT通路从而调控细胞存活、细胞增殖、血管形成等。尹玉新团队早期研究工作揭示细胞核内PTEN可以通过调节DNA复制进程、稳定基因组而发挥抑癌作用。此外,尹玉新团队发现除了传统PTEN蛋白,PTEN基因还可利用可变翻译起始位点编码新亚型蛋白:PTENα、PTENβ以及PTENε。PTEN新亚型蛋白呈现出与传统PTEN蛋白不同的亚细胞定位并发挥独特的生物学功能。总的来说,PTEN基因可通过多种途径发挥抑癌功能,但目前报道的机制尚不能完全阐明PTEN基因功能的多样性以及对肿瘤发生发展调控地位的重要性。
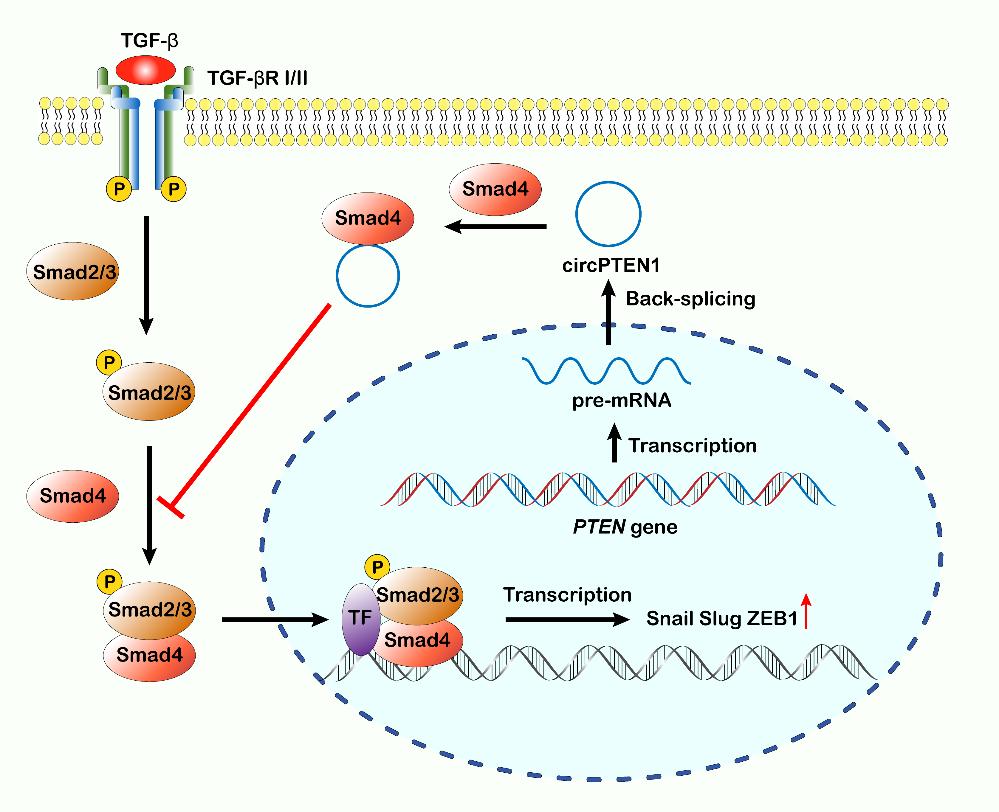
circPTEN1结合Smad4进而拮抗Smad复合物的形成和入核
环状RNA(circular RNA,circRNA)是一类共价键连接、不具有3’和5’末端头尾结构的环状非编码RNA。研究揭示circRNA与多种人类肿瘤的发生发展密切相关,因此深入研究并阐明circRNA对肿瘤发生发展的调控作用和具体机制具有重要意义。本研究中尹玉新团队鉴定了一种由PTEN mRNA第1至5外显子环化剪接生成的环状RNA:circPTEN1。circPTEN1在结直肠癌组织中表达下调,临床分析表明circPTEN1 的表达水平与结直肠癌患者的预后密切相关,敲低circPTEN1 促进结直肠癌的侵袭和转移,而 circPTEN1 的过表达则表现出显著抑癌效应。他们发现circPTEN1 能够结合 Smad4以减少 Smad 复合物的形成和细胞核定位,进而拮抗TGF-β/Smad通路介导的转移关键基因的表达、抑制结直肠癌的侵袭和转移。circPTEN1的鉴定进一步揭示了PTEN基因家族成员的多样性,为PTEN基因的复杂功能提供了分子基础,同时也为靶向TGF-β/Smad通路调控肿瘤侵袭和转移的治疗策略提供了新的靶点和研究方向。
北京大学基础医学院2018级硕士研究生郑林和梁会副研究员为共同第一作者。北京大学系统生物医学研究所尹玉新教授和基础医学院病理系梁会副研究员为共同通讯作者。本工作得到了北京大学人民医院胃肠外科姜可伟主任和王权博士的大力支持。该研究得到国家重点研发计划、国家自然科学基金重点项目、国家自然科学基金面上项目,北大-清华生命科学联合中心以及中国科协青年人才托举工程项目的支持。
原文链接:https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-022-01495-y
(北京大学基础医学院)