

2022年7月5日,北京大学基础医学院刘昭飞教授与北京大学肿瘤医院李囡主任医师以及北京大学第一医院杨兴研究员团队合作在The Journal of Clinical Investigation在线发表题为“Noninvasive interrogation of CD8+ T cell effector function for monitoring tumor early responses to immunotherapy”的研究论文。报道了一种新型正电子发射计算机断层(PET)成像探针,通过对肿瘤免疫治疗过程中活化T细胞分泌的颗粒酶B的在体成像精确反映细胞毒性T细胞的效应功能,进而实现对肿瘤免疫治疗疗效的早期精准判断。

以免疫检查点阻断为代表的免疫疗法在黑色素瘤等肿瘤治疗领域取得了突破性的进展。然而,如何提高肿瘤免疫治疗的响应率和有效性仍是目前临床所面临的挑战。因此,迫切需要一种可靠的在体可视化方法,能够在肿瘤免疫治疗的早期精准预测患者的治疗响应、准确筛选可能的获益群体,以及指导临床及时调整给药方案等。在免疫治疗过程中,细胞毒性T细胞的效应功能依赖于颗粒酶B的分泌,其在穿孔素的帮助下进入肿瘤细胞,通过激起半胱氨酸蛋白酶的级联反应触发细胞凋亡通路,进而造成肿瘤细胞的死亡。颗粒酶B的分泌代表了多重免疫调控通路下的最终信号,体现了细胞毒性T细胞对肿瘤细胞的潜在杀伤能力,是评估肿瘤特异性细胞毒性T细胞效应功能的潜在靶点。
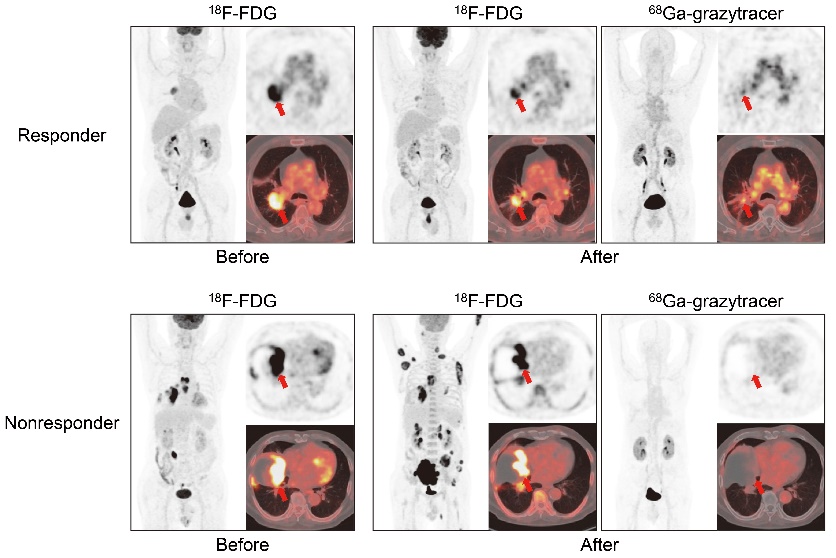
基于颗粒酶B特异性底物序列,研究团队首先进行了探针结构的设计与筛选,最终优化出颗粒酶B高特异性小分子PET成像探针并将其命名为68Ga-grazytracer。研究发现,68Ga-grazytracer能够在多种肿瘤模型中有效预测免疫检查点阻断及过继性T细胞疗法的治疗疗效。与目前临床最常用的肿瘤显像探针氟代脱氧葡萄糖(18F-FDG)相比,68Ga-grazytracer能够在具有不同免疫原性的小鼠肿瘤模型中准确地判断免疫治疗后肿瘤的治疗无效或假性进展。为了验证动物实验结果,在获得医学伦理许可后,研究团队开展了初步的临床试验(NCT05000372)。在免疫治疗有效的患者,68Ga-grazytracer呈现显著的肿瘤高摄取,提示患者肿瘤内出现大量的T细胞激活及颗粒酶B分泌,后续随访发现该患者的肿瘤基本完全消除。而出现68Ga-grazytracer无肿瘤摄取的患者,提示其肿瘤内缺乏有效的T细胞激活,即治疗无效,在后续的随访中发现已经出现了全身的肿瘤转移。
综上所述,该研究以颗粒酶B为靶点研发了特异性显像探针68Ga-grazytracer。基于68Ga-grazytracer的PET显像可以在体可视化T细胞在肿瘤内的效应功能,有望实现包括免疫检查点阻断、嵌合抗原受体T细胞(CAR-T)疗法在内的多种免疫治疗手段的疗效早期精准预测,为指导肿瘤患者分层及临床决策制定提供有效的信息。
刘昭飞教授课题组2020级直博生周昊毅和2013级八年制博士研究生王琰璞为本文的共同第一作者,刘昭飞教授、李囡主任医师和杨兴研究员为本文的共同通讯作者。北京大学基础医学院王凡教授、北京大学肿瘤医院核医学科杨志研究员及朱华研究员为本研究提供了重要的指导和帮助。团队成员徐红闯博士、沈秀玲同学、张婷博士、周欣博士等也为本研究做出了重要贡献。该研究得到北京大学临床+X青年专项、国家重点研发计划、国家自然科学基金,以及北京市自然科学基金等科研项目的大力支持。
原文链接:https://www.jci.org/articles/view/161065
(北京大学基础医学院)