

天然免疫是宿主抵抗病原入侵的第一道防线 [1, 2]。当病毒感染时,宿主细胞中的模式识别受体(PRRs)能够识别病毒来源的病原相关分子模式(PAMPs),进而快速诱导抗病毒相关基因的表达 [3]。染色质开放和基因表达的调控是宿主抵御病毒感染的关键环节,这赋予了宿主及时有效地表达抗病毒基因的表达模式 [4, 5]。
北京大学基础医学院游富平课题组长期以来一直致力于研究病毒感染后新型模式识别和特异染色质开放性调控的分子机制。此前实验室发现脚手架蛋白SAFA(hnRNPU)作为一个新型的细胞核内病毒dsRNA监测器能够识别病毒感染在细胞核内产生的dsRNA,连接染色质重塑和抗病毒天然免疫反应(详见《BioArt》公众号报道:Cell Host & Microbe亮点 | 游富平组发现细胞核内病毒RNA受体SAFA连接天然免疫识别和染色质重构;Cell Host & Microbe,2019)。后续发现SAFA和互作的RNA协作调节抗病毒相关染色质的打开,以促进抗病毒相关免疫基因的表达(详见《病毒学界》公众号报道:PLoS Pathogens |北京大学游富平课题组揭示病毒感染调节染色质开放性的新机制;PLoS Pathogens, 2022)。然而SAFA和其相关RNA是如何特异性的调节染色质开放还有待揭示?

2023年8月18日,北京大学基础医学院游富平课题组在Science Advances上发表了题为XAF1 promotes anti-RNA virus immune responses by regulating chromatin accessibility的最新研究成果。此研究发现RNA病毒感染后,转位进入细胞核的XAF1被招募至IRF1周围,通过阻断染色质阻遏物TRIM28的SUMO化,诱发大量新生RNA的产生(包括内在逆转录病毒)。新生RNA结合并激活SAFA,进而特异性打开IRF1附近染色质,增强 IRF1 调节的先天免疫基因的转录,从而启动干扰素非依赖的先天免疫反应。 另一方面,XAF1 和 IRF1 促进 IRF3 靶向的染色质打开,从而启动干扰素依赖的先天免疫反应。
在这项研究中,研究者首先利用邻近标记(TurboID)的技术结合质谱的方法,通过对比实验组结果找到并验证了在水泡性口炎病毒(VSV)感染后与线粒体外膜蛋白MAVS高亲和力相互作用的核质分布蛋白XAF1。过表达XAF1显著增强RNA病毒免疫反应,相一致地,XAF1的敲除削弱了抗RNA病毒免疫反应。
接下来,通过组分分离技术,研究者证实在RNA病毒感染后,XAF1会从细胞质转位进入细胞核,其核转位是发挥抗病毒功能所必须的。并发现XAF1的入核是由TBK1对其252位丝氨酸磷酸化所介导的。为了进一步探讨XAF1参与抗病毒免疫反应的核内机制,研究者在RNA病毒感染后分离并收集细胞核,对内源XAF1富集后并进行蛋白质谱分析。质谱结果显示,RNA病毒感染后XAF1在细胞核内除了与IRF1相互作用外还可以与TRIM28发生相互作用。TRIM28作为一个表观遗传共抑制蛋白,在各种组织中广泛表达。TRIM28通过SUMO依赖的方式招募组蛋白甲基转移酶SETDB1。SETDB1在转座子元件(TE)位点上产生抑制性的组蛋白标记(H3K9me3),这些标记招募异染色质蛋白1(HP1),诱导DNA异染色质化和TE抑制 [6]。TRIM28的SUMO化丢失会导致异染色质化的DNA打开从而促进TE的表达 [7]。在某些情况下,TE表达可以通过顺式作用促进先天免疫反应。尽管在病毒感染过程中,TRIM28的SUMO化会丢失,但目前尚不清楚TRIM28 SUMO化在病毒感染后丢失的机制。XAF1的过表达能够抑制TRIM28的SUMO化,XAF1的敲除的情况下TRIM28的SUMO化在病毒感染时基本无变化,于此一致的是染色质开放程度也随之变化。除此之外,在TRIM28敲除的细胞中,XAF1的过表达和缺失均无抗病毒表型的差异。因此,XAF1的发挥抗病毒功能是依赖于其入核与TRIM28相互作用,TRIM28是XAF1的下游效应分子。
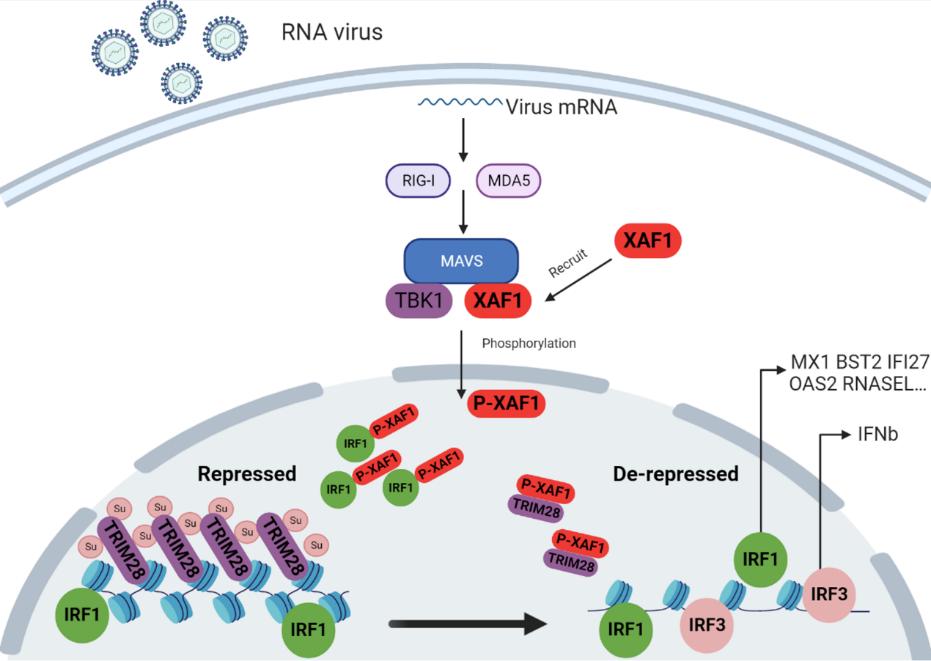
总而言之,这项研究为RNA病毒感染后,染色质特异性开放提供了新的机制见解。一方面,XAF1与IRF1相互作用并通过抑制TRIM28自身 SUMO化开放其周围染色质。另一方面,XAF1和IRF1 促进IRF3靶向的染色质打开。
北京大学基础医学院游富平研究员为本文的通讯作者;北京大学基础医学院博士生邝鸣、博士后赵英池、博士后于海涛为本文共同第一作者。北京大学游富平课题组博士生刘天一、李思几也在该研究中做出重要贡献。
1. McNab, F.; Mayer-Barber, K.; Sher, A.; Wack, A.; O'Garra, A., Type I interferons in infectious disease. Nat Rev Immunol 2015, 15, (2), 87-103.
2. Yan, N.; Chen, Z. J., Intrinsic antiviral immunity. Nat Immunol 2012, 13, (3), 214-22.
3. Desmet, C. J.; Ishii, K. J., Nucleic acid sensing at the interface between innate and adaptive immunity in vaccination. Nat Rev Immunol 2012, 12, (7), 479-91.
4. Cao, L.; Liu, S.; Li, Y.; Yang, G.; Luo, Y.; Li, S.; Du, H.; Zhao, Y.; Wang, D.; Chen, J.; Zhang, Z.; Li, M.; Ouyang, S.; Gao, X.; Sun, Y.; Wang, Z.; Yang, L.; Lin, R.; Wang, P.; You, F., The Nuclear Matrix Protein SAFA Surveils Viral RNA and Facilitates Immunity by Activating Antiviral Enhancers and Super-enhancers. Cell Host Microbe 2019, 26, (3), 369-384 e8.
5. Cao, L.; Luo, Y.; Guo, X.; Liu, S.; Li, S.; Li, J.; Zhang, Z.; Zhao, Y.; Zhang, Q.; Gao, F.; Ji, X.; Gao, X.; Li, Y.; You, F., SAFA facilitates chromatin opening of immune genes through interacting with anti-viral host RNAs. PLoS Pathog 2022, 18, (6), e1010599.
6. Hale, B. G., Antiviral immunity triggered by infection-induced host transposable elements. Curr Opin Virol 2022, 52, 211-216.
7. Schmidt, N.; Domingues, P.; Golebiowski, F.; Patzina, C.; Tatham, M. H.; Hay, R. T.; Hale, B. G., An influenza virus-triggered SUMO switch orchestrates co-opted endogenous retroviruses to stimulate host antiviral immunity. Proc Natl Acad Sci U S A 2019, 116, (35), 17399-17408.
(基础医学院)