

6月20日,权威国际期刊Nature Communications(IF="11.965)在线发表了北京大学中国天然药物及仿生药物国家重点实验室王坚成教授团队的最新研究成果“Regulating Intracellular Fate of siRNA by Endoplasmic Reticulum Membrane-Decorated Hybrid Nanoplexes”(内质网膜修饰的杂化纳米复合物调控siRNA胞内命运)。博士研究生邱崇为第一作者,王坚成教授为责任作者。该研究工作得到了国家自然科学基金面上基金(81473158、81773650)和重点项目(81690264),以及新药创制重大专项课题(2018ZX09721003-004)的支持。
核酸药物(siRNA)常用阳离子载体实现细胞转染,然而该类载药系统经细胞内吞后往往容易遭受溶酶体途径的降解破坏,导致仅有很少量的核酸药物能够从溶酶体内实现逃逸,严重制约了核酸药物(siRNA)基因沉默效应,如何突破溶酶体降解是提升核酸药物细胞转染效率亟需解决的关键科学问题。
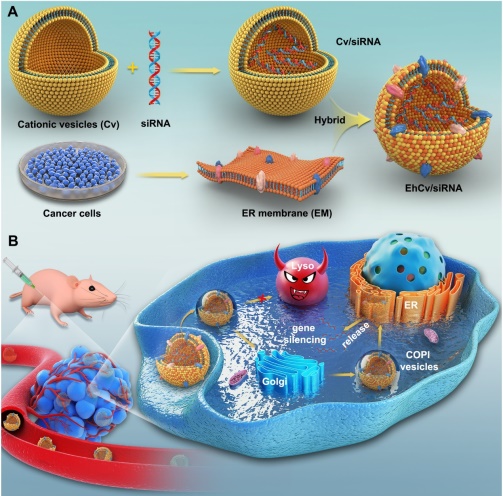
仿生型siRNA递送载体有效促进载siRNA纳米载体的细胞摄取,入胞后的载药颗粒躲避了“内吞体-溶酶体”途径降解破坏,并在细胞质中显著提高了siRNA有效释放量
王坚成团队在自主设计的功能化阳离子载体改善核酸药物(siRNA)溶酶体逃逸能力的研究成果(ACS Applied Materials & Interfaces, 2018, 10(26): 21847-21860;Nanoscale, 2016, 8(26): 13033~13044;, Journal of Controlled Release, 2016, 235: 99~111;Biomaterials, 2014, 35(6): 2066~2078;Biomaterials, 2014, 35(18): 5028~5038)基础上,又提出了采用内质网膜修饰的仿生载体策略进一步调控胞内siRNA命运,并在细胞水平上系统地阐明该仿生载体在胞内转运途径和作用机制。该论文研究依据细胞内囊泡转运从高尔基体回溯内质网的工作原理,首次采用从肿瘤细胞中提取的内质网膜来修饰阳离子脂质纳米载体,制备得到仿生型siRNA递送载体。该仿生载体凭借内质网膜上SNAREs及驻留蛋白等多种蛋白信号的介导,有效促进载siRNA纳米载体的细胞摄取,入胞后的载药颗粒经过非降解性“内吞体-高尔基体-内质网”途径转运,有效躲避了“内吞体-溶酶体”途径降解破坏,并在细胞质中显著提高了siRNA有效释放量,明显改善了siRNA基因沉默效应和抗肿瘤效应。该研究结果将为设计新型仿生载药系统提高肿瘤治疗效率提供重要参考指导。
王坚成团队近年来专注于siRNA递送的关键科学问题,设计构建了若干新型非病毒功能化载体,探索研究其改善siRNA递送效应及其机制,取得了显著的科研成果,在Biomaterials、Journal of Controlled Release、ACS Appl Mater Interfaces、Nanoscale、Molecular Therapy-Nucleic Acids等国际权威学术期刊杂志连续发表15篇SCI学术论文,在siRNA递送领域形成了课题组的研究特色。
(天然药物及仿生药物国家重点实验室)
【王坚成教授简介】

王坚成,北京大学药学院教授,博士生导师,天然药物及仿生药物国家重点实验室独立PI,北京大学医学部科研处副处长(挂职)。教育部新世纪优秀人才,北京市科技新星,中国药学会药剂专业委员会委员,北京药学会药剂专业委员会副主任委员,《中华医学百科全书药剂学分卷》副主编,国家卫健委3D打印医学应用专家委员会委员,中国医药生物技术协会纳米生物技术分会委员,中国药学会继续教育工作委员会委员。研究领域:生物大分子药物(蛋白多肽和siRNA)体内给药系统研究、靶向性纳米药物递送系统研究。负责主持国家自然科学基金5项,承担国家重大新药创制儿童药研发技术平台等国家级和省部级项目5项,共发表学术论文128篇,其中SCI学术论文92篇,获新药证书1项,临床批件2件,专利证书17件,主译书籍《纳米粒药物输送系统》。