

质膜质子ATP酶(Pma1)是真菌细胞膜上丰度最高的蛋白,也是最主要的ATP消耗者,对真菌细胞至关重要。Pma1属于P3A型ATPase,在低pH条件下利用ATP水解磷酸化提供能量来驱动H+从胞内向胞外主动运输,从而保持胞质pH稳定,并维持细胞膜电势,为营养物质跨膜运输提供能量。质膜H+-ATPase不存在于哺乳动物细胞,是热门的广谱抗真菌药物研发靶点。与其他P型ATP酶不同,Pma1以六聚体形式存在,但其六聚体功能意义尚不清楚。
2025年5月24日,北京大学基础医学院生物物理学系柏林研究员团队在《Cell Reports》杂志在线发表了题为“Assembly and cooperative mechanism of the hexameric fungal plasma membrane H+-ATPase”的研究论文。该研究系统解析了真菌质子泵Pma1六聚体协同运作的分子机制,为靶向Pma1开发广谱抗真菌药物提供了新策略。

本研究首先基于Pma1六聚体与单体的酶活动力学分析发现Pma1六聚体活性具有协同效应,提示其可以更高效转运质子(图1)。随后,研究者利用冷冻电镜技术发现Pma1的N末端区域(NTE)通过一段带负电的短螺旋结构与相邻亚基正电荷密集的结合口袋形成稳定互作,这种“域交换”连接将六聚体相邻亚基的构象运动联为一体,从而形成协同效应。本研究还发现在功能实验中删除NTE或者扰乱其与相邻亚基结合界面的关键位点,均会导致Pma1活性下降或完全丧失,无法维持细胞的正常生长,进一步证实了NTE在协同作用和细胞功能中的关键作用。
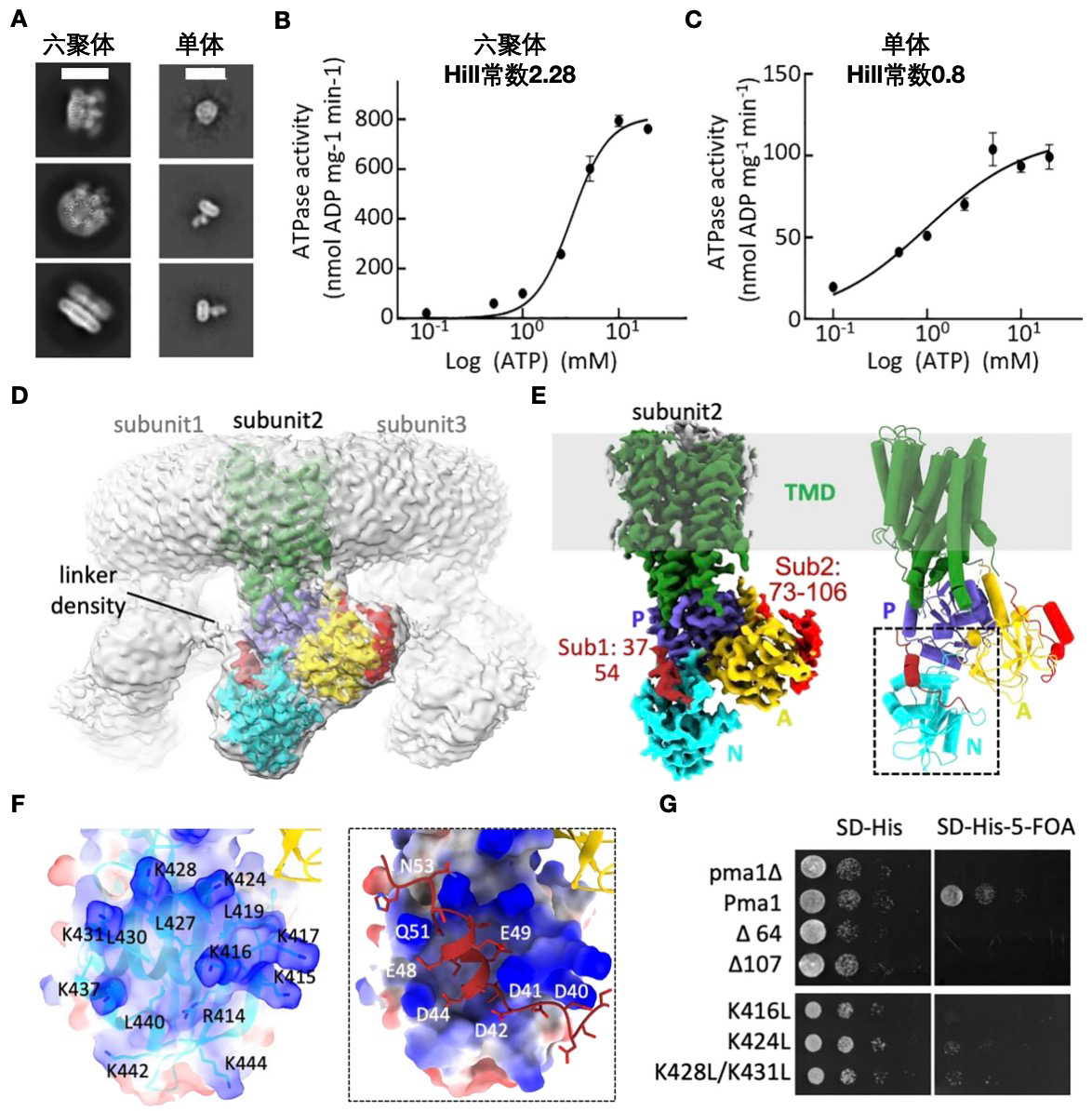
图1:“域交换”的NTE介导Pma1六聚体的协同效应
该项研究首次提出了Pma1以协同方式运作的分子模型,指出“域交换”NTE在调控质子泵活性中的重要作用,为解析真菌质子泵的能量转换机制提供了重要线索,并为抗真菌药物筛选与优化提供了新的位点和结构基础(图2)。
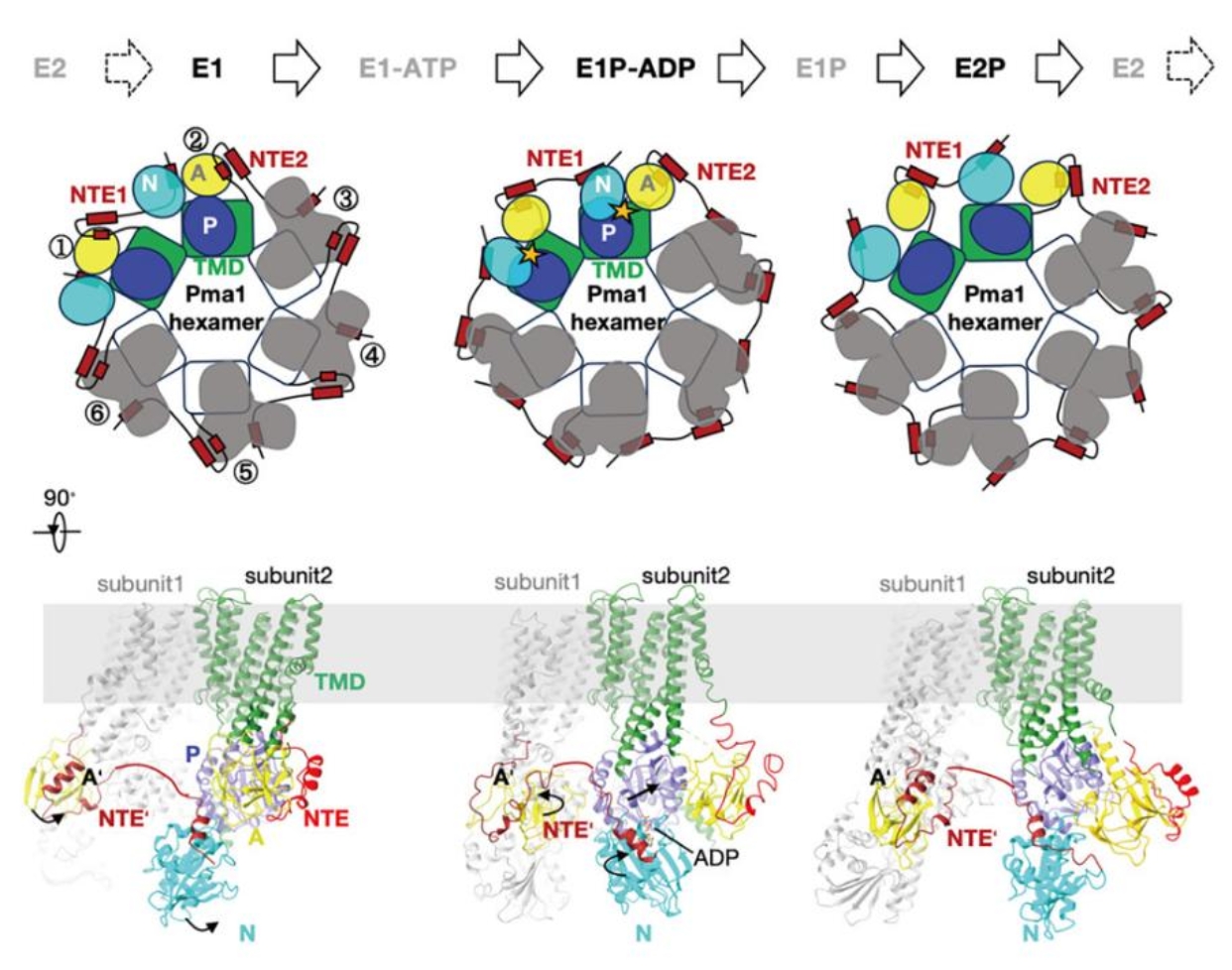
图2:Pma1六聚体协同作用模型
北京大学基础医学院生物物理学系柏林研究员为本研究论文的独立通讯作者。北京大学基础医学院博士研究生游子龙为论文的第一作者。本研究还得到了北京大学基础医学院生物物理学系云彩红教授的支持和帮助。本研究获得了国家自然科学基金面上项目、海外优秀青年基金、北京市自然科学基金面上项目等资助。
原文链接: https://www.cell.com/cell-reports/fulltext/S2211-1247(25)00524-8