


研究背景
近期,北京大学韩鸿宾教授团队与中国科学院化学研究所肖海华研究员合作,成功研发光控Co(III)纳米药物(NanoCo),利用具有深部穿透能力的二区近红外光,特异性作用于肿瘤细胞外间隙微环境的无毒钴(III)前药,从而建立具备光热效应、化学和免疫治疗多模式协同的肿瘤精准治疗新模式、新方法。
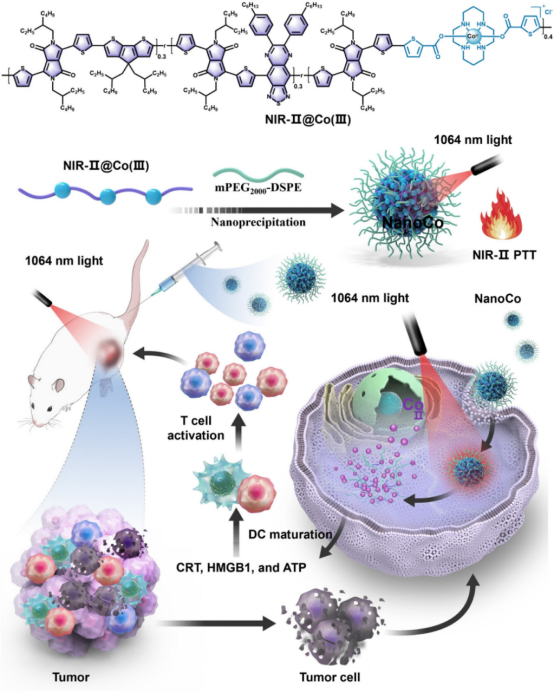
图1. NIR-II光激活的Co(III)纳米颗粒,集成了化疗和PTT用于癌症的光激活化疗-免疫疗法
研究内容
钴基配合物作为癌症治疗中具有前景的金属药物,其传统钴(II)制剂因缺乏选择性常导致系统性毒性。为提高治疗的靶向性,研究者提出利用无毒的钴(III)前药,在肿瘤细胞外间隙微环境中,通过特异还原细胞毒性钴(II)来实现肿瘤精准杀伤。具体是开发了近红外二区(NIR-II,1000–1700 nm)光控的Co(III)纳米药物(NanoCo)。NanoCo在1064 nm激光照射下表现出高达64.2%的光热转换效率,远超多数已知光热材料。光照不仅有效产热,还可加速Co(III)向Co(II)的还原,从而在时间和空间上精确控制细胞毒性金属物种的释放。该过程同步诱导免疫原性细胞死亡(ICD),促进树突状细胞成熟与抗肿瘤免疫应答,实现了光热治疗、化学治疗与免疫治疗的多模式协同。相关成果以题为“NIRII Photoactivatable Cobalt(III) Nanoparticles for Photoactivated Metal ChemoImmunotherapy”发表于《Advanced Materials》。
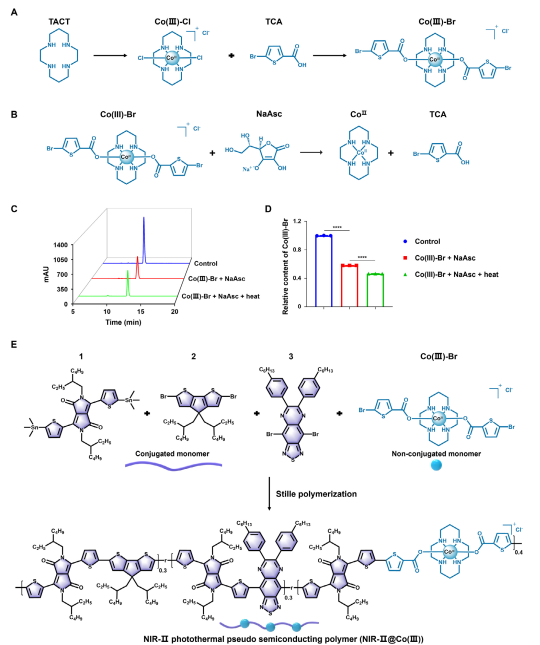
图2. NIR-II@Co(III)的合成与表征
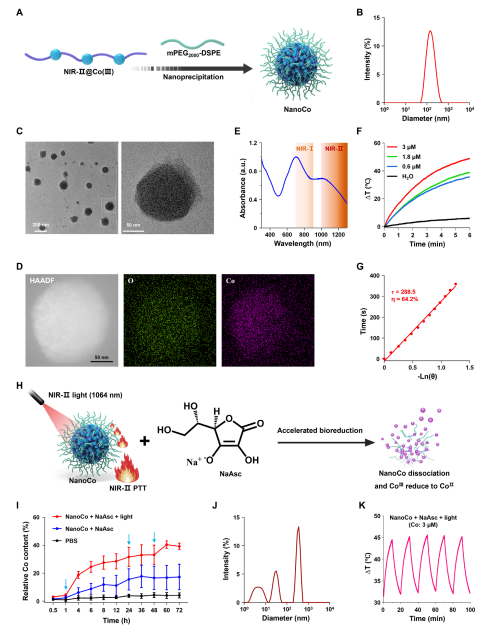
图3. NanoCo的制备与表征
文章亮点
NIR-II光控纳米技术的突破性意义在于其针对脑细胞外间隙药物控释的独特优势:1)精准递送与控释:纳米载体可被设计为靶向递送至特定脑区的细胞外间隙,利用临床已经在用的NIR相关设备的改造,就可以实现脑区药物的无损、远程激活释放。2)调控间隙内物质扩散:光热‑化学协同效应能够动态调节脑细胞外间隙内的药物分子扩散行为,增强局部药物分布与滞留。3)为脑疾病提供新型治疗范式:该技术通过实时、可逆地调控脑细胞外间隙内的药物动力学,为阿尔茨海默病、脑肿瘤等重大神经系统疾病开辟了微创、精准且具有时空分辨的治疗途径,推动脑科学从静态观测向“动态干预‑实时观测‑精准调控”的研究范式跨越。
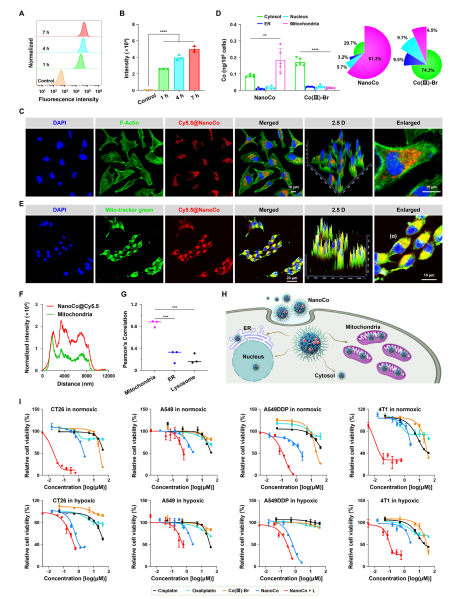
图4. NanoCo在线粒体中积累,并在NIR-II照射下杀死癌细胞
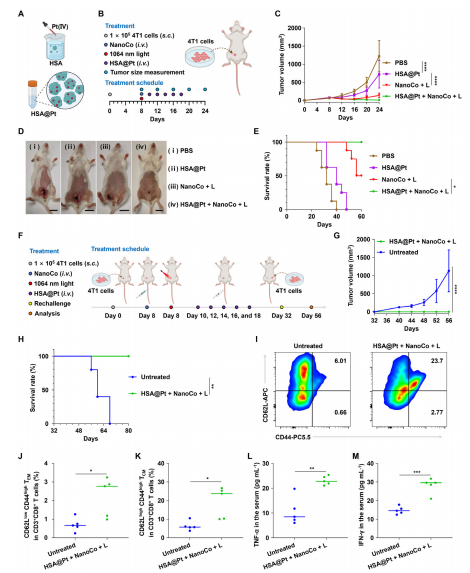
图5. HSA@Pt + NanoCo + L 在 4T1 肿瘤携带小鼠模型中消除肿瘤并诱导长期免疫记忆效应
总结与展望
韩鸿宾团队自2005年开始即聚焦于脑细胞外间隙的系统研究,近20年来,应用所设计发明的磁示踪组织通道测量仪,成功发现了脑内新分区系统-细胞外间隙分区系统,证实间隙内组织液呈分区引流,更新了以往关于细胞外间隙是高度通连的传统认识,为建立经细胞外间隙途径的脑肿瘤治疗提供关键依据。
该研究获得北京市高精尖学科基金的支持,北京大学医学技术研究院韩鸿宾教授、人民医院尚琨博士和中科院化学所肖海华教授为共同通讯作者,体现了以临床重大问题为导向、基础与临床学科深度交叉融合的研究路径,展现了通过医工交叉与多学科协作推动科技创新、服务健康中国建设的坚定努力。
原文信息
D. Tang, M. Cui, J. Karges, et. al., NIR-II Photoactivatable Cobalt(III) Nanoparticles for Photoactivated Metal Chemo-Immunotherapy, Adv. Mater., 2025, e16008. https://doi.org/10.1002/adma.202516008